L’immunothérapie révolutionne depuis peu les méthodes de traitement du cancer. L’utilisation du système immunitaire pour lutter contre les tumeurs est devenue moins toxique, plus spécifique et plus efficace que les traitements traditionnels, comme la chimiothérapie et la radiothérapie. Aujourd’hui, le traitement par cellules CAR-T, l’une des options thérapeutiques les plus prometteuses, offre une solution particulièrement novatrice de lutte contre les maladies complexes, telles que le cancer.
Les cellules CAR-T sont fabriquées à partir des lymphocytes T, qui font partie intégrante de notre système immunitaire. Les lymphocytes T proviennent soit de l’organisme du patient lui-même, on parle alors de thérapies « autologues » - deux produits ont déjà été approuvés par la Food & Drug Administration FDA qui approuve l’autorisation de commercialisation des médicaments aux Etats-Unis, soit d’un donneur sain. On parle alors de thérapies « allogéniques », actuellement en phase de développement préclinique et clinique. Afin de remplir leur fonction anti-cancer, les cellules doivent être « équipées » d’un récepteur antigénique chimérique (CAR, pour Chimeric Antigen Receptor) afin de mieux détecter et tuer les cellules cancéreuses. Cette modification se fait dans des laboratoires spécialisés, où l’on génère le code génétique de lymphocytes T vivants pour exprimer les CAR. Les cellules CAR-T sont alors prêtes à être réinjectées dans l’organisme du patient afin d’entamer leur lutte contre le cancer.
Peut-on dire que les cellules CAR-T constituent une révolution qui va transformer pour toujours les méthodes de traitement du cancer ? Si leur développement est en pleine expansion, il reste de nombreux obstacles à lever afin de déployer efficacement ces thérapies partout dans le monde. Les technologies actuelles connaissent en effet des limites, comme leur coût de fabrication élevé et les difficultés logistiques, en particulier pour thérapies autologues disponibles. Dans ces conditions, les traitements par cellules CAR-T allogéniques, ou « prêts à l’emploi », offrent-ils une solution plus accessible et plus rentable ?
Un peu d’histoire et de science
Au sein du système immunitaire, les lymphocytes T ont pour mission de tuer les cellules infectées, cancéreuses ou abimées[1]. Or, malheureusement, il arrive que les cellules cancéreuses parviennent à se camoufler : le système immunitaire ne les détecte pas, ce qui rend caducs les mécanismes de surveillance innés. Les scientifiques ont donc eu l’idée de perfectionner les lymphocytes T afin de leur permettre de traquer et détruire plus efficacement ces cellules. Ils ont mis au point des lymphocytes T dotés d’une arme génétiquement codée : les récepteurs antigéniques chimériques (CAR). Les CAR sont conçus pour remplir une double fonction : fixer des biomarqueurs spécifiques (antigènes) sur les cellules cancéreuses et activer les mécanismes tueurs de cancer.
« ... jusqu’à 90 % de patients atteints de leucémie ont connu une remission complète et durable...»
Il a fallu plusieurs dizaines d’années de recherches en laboratoire pour transformer cette idée innovante en un traitement effectif chez le patient : le concept consistant à modifier en externe les cellules immunitaires des patients afin d’en améliorer les propriétés de lutte contre le cancer a été décrit pour la première fois il y a 30 ans[2]. Puis, en 2015, la technologie CAR-T a connu un franc succès : dans le cadre de plusieurs essais cliniques, jusqu’à 90 % de patients atteints de leucémie ont connu une rémission complète et durable[3] [4]. Dès lors, le nombre de travaux de recherche et d’études cliniques sur ce type de thérapie a augmenté de manière exponentielle : fin mai, au total, 293 essais actifs sur les CAR-T avaient déjà été recensés partout dans le monde[5] , contre 152, en 2017[6]. En 2018, deux de ces thérapies ont été approuvées dans le traitement de la leucémie et du lymphome aux États-Unis et en Europe : Yescarta, de Gilead Sciences, et Kymriah, de Novartis (également récemment approuvé au Japon, ce qui en fait la seule thérapie par cellules CAR-T disponible en Asie)[7]. Ces deux traitements impliquent l’utilisation des cellules des patients pour la fabrication du produit thérapeutique.
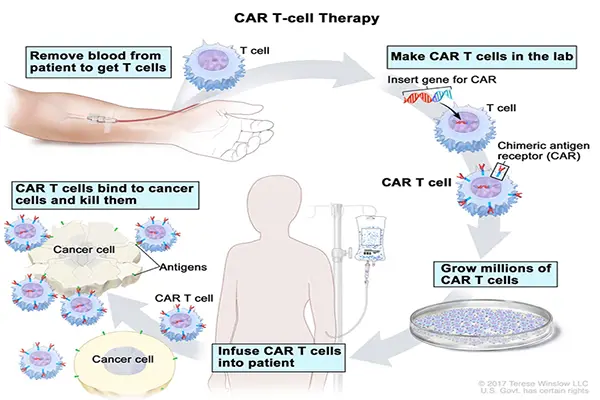
TRAITEMENT PAR CELLULES CAR-T (https://www.cancer.gov/types/leukemia/patient/child-all-treatment-pdq)/
Les cellules CAR-T sont fabriquées en insérant un gène dans le lymphocyte T. Ce gène permet de coder le récepteur antigénique chimérique : CAR (une protéine de synthèse de petite taille qui sera désormais produite par la cellule pour tapisser sa surface). La fonction des CAR consiste à fixer un biomarqueur spécifique (un antigène) sur la cellule cancéreuse. Une fois fixée à l’antigène du cancer, la cellule CAR-T est activée par la portion du CAR qui se propulse à l’intérieur du lymphocyte T et met en marche les mécanismes tueurs de cancer.
Une production délicate, une logistique complexe
Le processus de production de ce traitement personnalisé implique de collecter les globules blancs du patient, d’en extraire les lymphocytes T, de les envoyer à un site de fabrication spécialisé, où on les dote de CAR, de cultiver les lymphocytes T ainsi modifiés afin d’obtenir une dose thérapeutique suffisante, puis de renvoyer le produit préparé à l’hôpital pour administration au patient. Globalement, cela prend environ trois semaines et requiert deux cycles complexes de logistique du froid. Afin d’assurer la survie maximale des cellules, celles-ci doivent être conservées congelées. De même, afin de garantir une administration au bon patient, il est absolument nécessaire de préserver la chaîne d’identité[8]. En outre, le temps est compté : il faut prendre en compte le fait que cette thérapie est principalement utilisée chez les patients ayant déjà connu des rechutes à la suite d’autres traitements. Il se pourrait alors que l’on ne puisse pas procéder à ce que l’on appelle une « fenêtre thérapeutique » en raison de la progression rapide de la maladie. Par ailleurs, dans certains cas, l’état du patient (et celui de ses lymphocytes T) ne permet pas la production du traitement. Par exemple, lors des essais cliniques menés avant l’approbation de Yescarta, l’un des 111 patients n’a pas reçu le produit en raison d’une défaillance du processus de fabrication. Neuf autres patients n’ont pas été traités en raison de la progression de la maladie ou de graves complications après la collecte de leurs cellules[9]. D’une manière générale, sur le plan logistique, la production de cellules CAR-T est complexe, demande du temps et revient cher. De plus, la qualité du produit final est difficile à contrôler : chaque patient est différent, et il en va de même pour ses lymphocytes T et les cellules CAR-T qui en sont dérivées. Les patients qui fournissent le matériau de base dans le cadre des thérapies autologues présentent en effet des antécédents médicaux divers et variés, différents stades de la maladie et différents patrimoines génétiques. Tous ces facteurs contribuent aux complications rencontrées en amont du processus de production. Cette méthode se distingue donc considérablement d’un processus de fabrication standard, bien défini.
« Dans le cas d’un produit provenant des patients eux-mêmes et dépendant d’autant de variables, difficile de justifier un modèle tarifaire traditionnel.»
La barrière du coût
Dans le cas d’un produit provenant des patients eux-mêmes et dépendant d’autant de variables, difficile de justifier un modèle tarifaire traditionnel, qui prendrait en compte la recherche et le développement, la fabrication et la logistique. On pourrait alors adopter un modèle reposant sur les résultats : le prix du médicament dépendrait du bénéfice fourni, plutôt que du coût du développement et de fabrication. Néanmoins, il peut être dangereux d’avoir recours à ce système de tarification pour des médicaments indispensables : les cellules CAR-T étant souvent utilisées en dernière intention, cela reviendrait presque à estimer le prix de la vie humaine[10]. Pour autant, les investissements engagés par les sociétés pharmaceutiques sont considérables : Novartis a dépensé plus d’un milliard de dollars depuis 2012 pour mettre Kymriah sur le marché, et Gilead s’est acquitté de près de 12 milliards de dollars pour acheter Kite Pharma, qui a développé Yescarta. Et si Novartis avait d’abord suggéré que seuls les patients réagissant à la thérapie au cours du premier mois de traitement se verraient facturer le prix total de Kymriah, l’idée a depuis été abandonnée[11]. Yescarta et Kymriah coûtent respectivement 373 000 dollars et 475 000 dollars par patient. En 2018, les ventes de Yescarta se sont élevées à 264 millions de dollars, et le premier trimestre 2019 a généré 96 millions de dollars de recettes, un chiffre légèrement en deçà du consensus de 105 millions de dollars. S’agissant de Kymriah, les ventes ont atteint 76 millions de dollars en 2018, et 45 millions au premier trimestre 2019[12]. En raison de leur prix élevé, ces deux thérapies font l’objet d’une certaine réticence des autorités chargées de l’approbation et des compagnies d’assurance. Ainsi, tout effort de réduction des coûts de fabrication aura un impact positif sur l’accessibilité des thérapies par cellules CAR-T.
Les donneurs sains, une solution...
La plupart des problèmes cités ci-dessus pourrait être résolue par les thérapies allogéniques qui, au lieu d’utiliser les cellules des patients, ont recours à celles de donneurs sains non apparentés. Le fait que les cellules de donneurs sains soient plus facilement disponibles permet de prélever uniquement les lymphocytes T parfaitement adaptés à la lutte contre le cancer, ce qui est impossible lorsque le produit thérapeutique est dérivé du patient et que les cellules capables de lutter pour sa survie sont rares. Par ailleurs, contrairement à l’approche CAR-T autologue, où le résultat thérapeutique dépend d’une seule dose de traitement, les cellules CAR-T prêtes à l’emploi pourraient offrir la flexibilité du dosage répété. De même, l’utilisation de cellules de donneurs pourrait améliorer la qualité et l’innocuité du produit final. Enfin, le coût élevé de la logistique du froid, qui implique souvent un acheminement sur plusieurs continents, pourrait, en théorie, être réduit de moitié, puisque les cellules dérivées de donneurs et dotées de CAR seraient transportées une seule fois, du site de fabrication vers l’hôpital. Si l’on parvient à mettre en place un processus de fabrication et de livraison plus rentable, de toute évidence, les prix baisseront, les compagnies d’assurance se montreront plus disposées à rembourser ces thérapies et les patients pourront y accéder plus facilement.
... mais également de nouveaux défis
Si le traitement du cancer par des cellules provenant de donneurs sains offre de belles perspectives en termes de survie des patients, il présente des risques considérables, et bien des incertitudes demeurent. D’abord, cette procédure se rapproche de celle d’une greffe, comme la greffe de cellules souches de moelle osseuse, où donneur et receveur doivent être parfaitement compatibles afin d’éviter toute réaction du greffon contre l’hôte (GVH). Cette maladie se développe lorsque des cellules CAR-T non compatibles ont été injectées et attaquent non seulement le cancer, mais également toutes les autres cellules au sein de l’organisme de l’hôte (le patient). Dans le même temps, il arrive que le système immunitaire du patient attaque les cellules étrangères et les tue avant qu’elles ne puissent détruire le cancer. On parle là de réaction de l’hôte contre le greffon (HVG). Il existe différentes méthodes pour résoudre ces problèmes. Par exemple, on peut chercher un donneur et un receveur compatibles[13]. Mais malheureusement, en raison des grandes disparités à la fois chez les patients et les donneurs potentiels, cette stratégie paraît trop chronophage pour avoir une utilité pratique. Les scientifiques ont donc découvert un moyen de contourner cet obstacle. Comme on l’a vu, dans le cadre de la production de cellules CAR-T, pour les traitements autologues comme allogéniques, l’étape la plus importante consiste à ajouter une protéine chimérique qui se fixe au cancer à la surface de la cellule. Les cellules d’un donneur tiers requièrent des modifications supplémentaires pouvant être effectuées à l’aide de techniques d’édition génique[14]. Par exemple, pour s’assurer de l’innocuité des cellules du donneur pour le patient et éviter une GVH, on peut retirer une molécule appelée TCR (pour T cell receptor) de la surface des cellules. En outre, afin de prévenir toute HVG, les cellules étrangères doivent être rendues indécelables par le système immunitaire du patient. Pour ce faire, différentes stratégies sont possibles, comme la réduction du taux de la protéine β2M. Certes, il n’est pas aisé de procéder à toutes ces modifications, mais grâce aux efforts de nombreux scientifiques, c’est déjà réalisable.
Le paysage concurrentiel et la perspective d’une fin d’année riche en nouveautés
Malgré tous ces nouveaux défis, les traitements par cellules CAR-T prêtes à l’emploi sont en cours de développement partout dans le monde et l’intérêt croissant pour les thérapies dérivées de donneurs se reflète déjà dans les statistiques des sociétés de logistique du froid comme Cryoport qui compte parmi les leaders en matière de logistique des matériaux sensibles aux températures, tels que les médicaments fabriqués à partir de cellules vivantes. Au premier trimestre 2019, plus de 30 % de ses services ont été fournis dans le cadre d’essais cliniques sur des thérapies allogéniques.
« Malgré tous ces nouveaux défis, les traitements par cellules CAR-T prêtes à l’emploi sont en cours de développement.»
Mené par Cellectis, le premier essai clinique sur ce type de traitements de la leucémie aiguë lymphoblastique récidivante/réfractaire a donné des résultats plutôt mitigés. Ces derniers étaient, certes, très encourageants, puisque la majorité des patients traités ont réagi de manière positive à la thérapie, mais deux patients sont décédés en raison de toxicité thérapeutique[15]. Le programme de Cellectis sur les traitements par cellules CAR-T allogéniques et le portefeuille d’actifs de thérapie cellulaire préclinique de Pfizer sont en cours de développement par Allogene, en collaboration avec Servier. Allogene a été fondée par deux anciens cadres de Kite Pharma ayant quitté Gilead. L’an prochain, la société devrait publier un rapport sur les premiers résultats de son traitement de la leucémie aiguë lymphoblastique. L’essai clinique sur le lymphome non hodgkinien récidivant/réfractaire vient, lui, de débuter. Cellectis contribue également au développement de trois autres produits candidats au traitement par cellules CAR-T allogénique en phase d’essai clinique : chacun cible différents types de cancer par le biais d’un antigène tumoral spécifique. On attend une mise à jour des données significative pour la fin de l’année. Par ailleurs, en novembre 2018, Celyad a annoncé l’injection chez un premier patient de son produit thérapeutique alloSHRINK CYAD-101 pour le traitement de cancer colorectal métastatique inopérable. CYAD-101 est né d’une ancienne collaboration de Celyad avec le Japonais ONO Pharmaceutical, qui travaille aujourd’hui avec Fate Therapeutics sur le développement de deux nouvelles thérapies cellulaires prêtes à l’emploi. Le projet préclinique de Fate se distingue considérablement de tous les autres traitements via cellules CAR-T par l’utilisation de cellules souches pluripotentes induites plutôt que des cellules de donneurs. En outre, le médicament candidat allogénique de Precision Biosciences destiné au traitement du lymphome non hodgkinien récidivant/réfractaire et de la leucémie aiguë lymphoblastique de type B est entré en phase clinique au mois d’avril. Les premiers résultats sont attendus pour fin 2019 ou début 2020. De son côté, CRISP Therapeutics AG, une société d’édition génique, lancera des essais cliniques dans le cadre de son programme CTX110 CD19 allo-CAR-T cette année. Son concurrent, Editas Medicine, travaille également au développement de traitements cellulaires allogéniques pour lutter contre le cancer, et Gilead a mis en place une collaboration avec Sangamo pour développer KITE-037, projet qui doit entrer dans sa phase clinique en 2020. Enfin, ATARA Biosciences, qui se penche actuellement sur l’immunothérapie allogénique par lymphocytes T en vue de cibler les infections virales et les cancers dus aux infections virales, a lancé quatre projets CAR-T dans le cadre de son pipeline préclinique.
« Le nombre d’innovations en matière d’immunothérapie augmente constamment, à mesure que les sociétés de santé s’engagent dans la lutte contre le cancer.»
Le nombre d’innovations en matière d’immunothérapie augmente constamment, à mesure que les sociétés de santé s’engagent dans la lutte contre le cancer. Actuellement, environ 140 sociétés dans le monde comptent au moins un programme thérapeutique fondé sur les cellules CAR-T[16]. De même, nombre d’entreprises travaillent spécifiquement sur les cellules CAR-T prêtes à l’emploi en laboratoire et dans le cadre d’essais cliniques. Chez Candriam, nous avons pour ambition de soutenir les développements les plus prometteurs. Nous procédons à une veille rigoureuse dans ce domaine et suivons de près les avancées technologiques. Cette analyse poussée implique notamment d’évaluer de manière stricte les technologies innovantes et d’en déduire l’impact potentiel sur le cours des actions des sociétés qui les développent. La stratégie d’investissement Oncologie de Candriam vise ainsi à soutenir les sociétés les plus dynamiques.
[1] https://www.nature.com/subjects/cytotoxic-t-cells
[2] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC298636/
[3] http://embomolmed.embopress.org/content/early/2017/07/31/emmm.201607485.long#DC4
[4] https://www.ncbi.nlm.nih.gov/pubmed/25317870?dopt=Abstract
[5] https://clinicaltrials.gov
[6] https://celltrials.org/public-cells-data/all-car-t-trials-cumulative-through-end-2017/56
[7] https://www.novartis.com/news/media-releases/kymriahr-tisagenlecleucel-first-class-car-t-therapy-from-novartis-receives-second-fda-approval-treat-appropriate-rr-patients-large-b-cell-lymphoma
[8] https://www.biopharmadive.com/news/car-t-supply-chain-cell-therapy-challenges-pharma/521560/
[9] https://www.yescarta.com/files/yescarta-pi.pdf
[10] https://www.europeancancerleagues.org/wp-content/uploads/2018/06/CAR-T-ECL-Article_Final_20062018.pdf
[11] https://cancerworld.net/cutting-edge/the-car-t-cell-revolution-what-does-it-offer-and-can-we-afford-it/
[12] https://www.evaluate.com/vantage/articles/news/corporate-strategy/novartis-hopes-kymriah-acceleration-can-save-its-car
[13] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5088751/
[14] https://www.ncbi.nlm.nih.gov/pubmed/30735463
[15] https://servier.com/wp-content/uploads/2018/12/PR_Servier-Allogene_ASH2018.pdf
[16] Séance d’éducation intitulée « Driving CARs in Aggressive Lymphoma » (Comment faire évoluer le traitement par cellules CAR-T du lymphome agressif) lors de l’assemblée annuelle 2019 de l’ASCO, du 31 mai au 4 juin 2019
